酶催化光化學領域的關鍵性突破!
2023-09-28 09:58
日前,西北大學化學與材料科學學院陳希教授與華中科技大學吳鈺周、鐘芳瑞教授合作,以共同通訊作者在 Nature 主刊在線發(fā)表文章“ Enantioselective [2+2]-cycloadditions with triplet photoenzyme s”。
酶是生命體重要的組成部分。酶催化具有高效、高度空間立體選擇性和綠色環(huán)保特性。近些年來,對酶的改造和定向進化在合成生物學領域有許多突破,但對于酶的高效光催化鮮有報道。
這項工作是酶催化光化學領域的關鍵性突破。研究者將三線態(tài)能量轉移這一典型的光催化模式整合到蛋白質中,通過基因重新編程,將功能改性的非天然氨基酸插入蛋白質,創(chuàng)造出含有三線態(tài)光敏劑的人工光酶,成功催化吲哚衍生物的分子內[2+2]光激發(fā)環(huán)加成反應,并且可以實現(xiàn)利用人工光酶與底物分子立體化學的非共價鍵相互作用控制[2+2]光激發(fā)環(huán)加成反應過程中的對映體選擇性,實現(xiàn)高達99%e.e對映體選擇性。
“三重態(tài)光酶”的藝術示意圖
對該人工酶的進化共經歷了四個階段。到第三個階段(TPe3.0),e.e值達到93%。為了進一步對該酶進行優(yōu)化,陳希教授團隊解析了該人工光酶與底物的復合體晶體結構,揭示了超分子蛋白質腔中的人工三線態(tài)光酶能量轉移反應活性極大提高和催化高度空間立體選擇性的機制:在疏水性蛋白質空腔內,通過π-π堆積作用,光能從非天然氨基酸傳導到底物,激活反應。底物和周邊氨基酸殘基的弱相互作用決定了產物單一手性構象。基于這個機制,該研究團隊設計了TPe4.0_FBP,將11位的丙氨酸突變?yōu)樘於0罚黾恿嗽摪被釟埢c底物的氫鍵作用。同時,在非天然氨基酸上添加了一個氟原子,增長了π-π共軛,并增加了一個C-F氫鍵。基于這些改造,e.e值最終達到99%。陳希教授團隊也成功解析了TPe4.0_FBP與底物的復合體晶體結構(后續(xù)工作),驗證了這一機制。
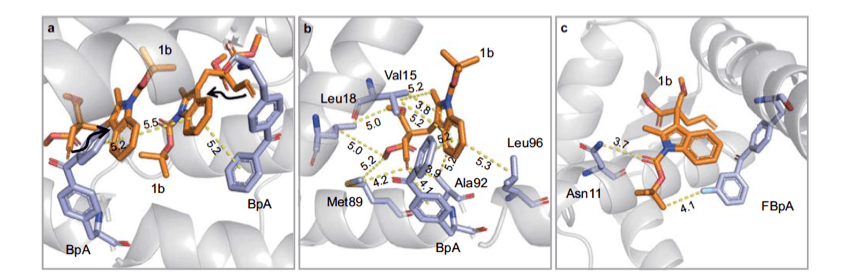
“三重態(tài)光酶”的催化機制
這項研究工作將化學光敏劑與蛋白質結構相結合,創(chuàng)造了新型“三重態(tài)光酶”,豐富了光驅動生物催化的功能和應用范圍。同時實現(xiàn)高手性控制,為醫(yī)藥、農藥、信息和材料領域的發(fā)展提供核心技術支持。
聯(lián)系我們


